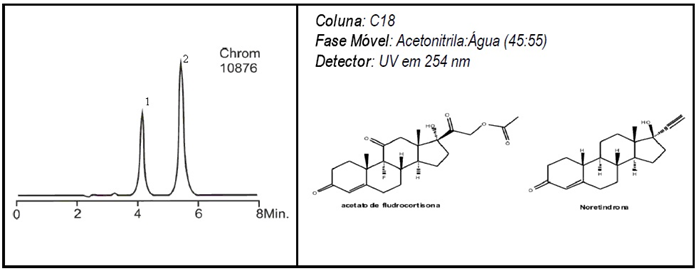
QUÍMICA ANALÍTICA INSTRUMENTAL
Sabendo que o hexano puro não possui absorbância significativa em comprimento de onda superior a 200 nm, mas que o benzeno tem um pico de absorção em 256 nm, um químico determinou a concentração de benzeno em uma amostra de hexano contaminada, procedendo da seguinte maneira:
- Ele adicionou 25,8 mg de benzeno (C6H6 78,11g/mol) em um balão volumétrico de 250mL e completou o volume com hexano.
- Ele mediu a absorbância da solução preparada no procedimento 1, em um espectrofotômetro, no comprimento de onda de 256 nm e usando uma cubeta de 1,000 cm, obtendo o valor de 0,266.
- Ele mediu a absorbância da amostra de hexano contaminada por benzeno, em um espectrofotômetro, no comprimento de onda de 256 nm, usando uma cubeta de 5,000 cm, obtendo o valor de 0,070.
Indique a alternativa que assinala, respectivamente, o valor da absortividade molar do benzeno e a concentração de benzeno na amostra contaminada de hexano.
201 M-1.cm-1 e 5,43mg/L
201 M-1.cm-1 e 27,1 mg/L
2,58 M-1.cm-1 e 27,1 mg/L
201 M-1.cm-1 e 0,0695 mg/L
2,58 M-1.cm-1 e 5,43 mg/L
Uma solução de um dado composto apresenta uma absortividade molar de 8,5x103 M-1 cm-1 em 450 nm. Qual será a absorbância de uma solução do mesmo composto na concentração de 1,2x10-5 mol/L quando medido em 450 nm em cubetas de 5,00 cm?
0,510
0,876
2,457
0,367
0,456
O manitol é um diurético e agente de diagnóstico para avaliação da função renal. Um lote de manitol está sob suspeita de estar contaminado por chumbo (Pb2+). Em uma análise foram pesados 200 mg de manitol sendo cuidadosamente transferido para um balão volumétrico de 250,0 mL. A medida dessa solução em um aparelho de absorção atômica equipado com lâmpada de chumbo, apresentou uma absorbância de 0,140. A medida de alguns padrões permitiu-se obter a seguinte curva de calibração:
Abs = 0,0178 CPb2+ - 0,0022 , onde CPb2+ está em mg/L.
Sobre a questão acima, pergunta-se: Calcule a concentração de Pb2+, em mg/L, na solução amostra de manitol.
4,875
7,988
7,742
2,963
5,455
A figura abaixo representa um cromatograma em que se realizou a separação de várias substâncias em fase estacionária apolar. Analisando o cromatograma, estrutura dos compostos e sabendo que a ordem de eluição é a ordem numérica dos compostos, assinale a alternativa que explica por que a substância 3 elui primeiro que a substância 4, mesmo sabendo que a substância 3 possua um grupo metil a mais que a substância 4.
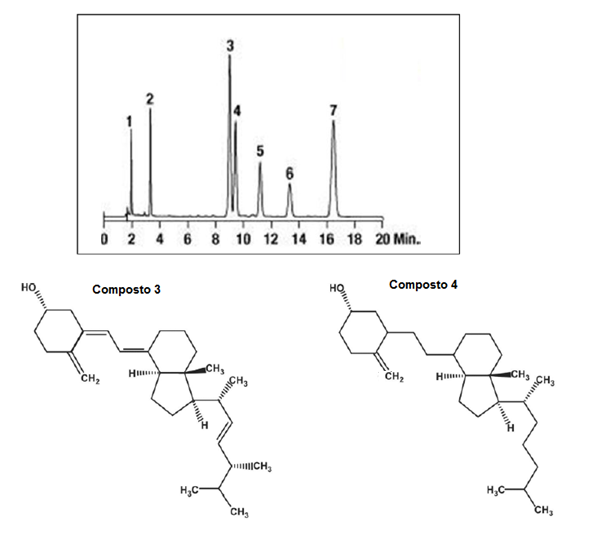
O composto 4 apresenta 1 hidroxila a mais que o composto 3.
O composto 2 tem polaridade igual ao composto 3, portanto repele esse composto, fazendo-o se aproximar do composto 4.
O composto 3 apresenta viscosidade maior que o composto 4, por isso percorre o leito mais rápido que o composto 4.
O composto 3 é ligeiramente mais polar que o composto 4, porque apresenta mais ligações duplas.
Os dois compostos são lipídeos com pontos de ebulição muito próximos.
A dipirona (sal de sódio do 1-fenil2,3dimetil-4-metilaminometanossulfonato5pirazolona) é um pó cristalino branco, solúvel em água e álcool, que apresenta atividades analgésicas e antipiréticas. Recentemente foi desenvolvida uma técnica para determinação de dipirona sódica em várias formulações farmacêuticas. A dipirona sódica quando em contato com íons prata (Ag+) são reduzidos a uma suspensão coloidal (suspensão de partículas) de prata metálica (Ag0), que é liberada pela reação e monitorada em 425 nm. A reação citada é apresentada a seguir:
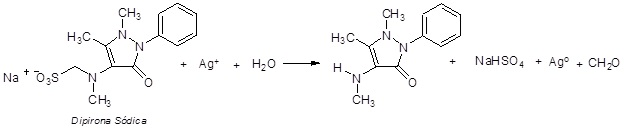
O método empregado para determinação de dipirona sódica em solução de Novalgina® foi de acordo com o procedimento a seguir: Transferiu-se 2,0 mL de Novalgina®para um balão volumétrico de 500 mL. Em seguida, 10,0 mL da última foram transferidos para um balão volumétrico de 100 mL, ao qual foi adicionado uma quantidade conveniente de íons Ag+, tendo seu volume completado até a marca. Posteriormente, efetuou-se a medida de absorbância dessa solução, encontrando uma absorbância de 0,048.
Abs = 0,228.C + 9,81x10-4 (g/L) r2 = 0,9996
A partir da curva analítica de calibração e informações anteriores, determine a concentração, de dipirona sódica, em mg/mL, na Novalgina.
515
1000
450
310
188
No curso de Química, um estudante realizou um experimento em que ele triturou um comprimido antidepressivo em um almofariz, em seguida, ele dissolveu a amostra do comprimido em solução de ácido clorídrico 0,1 mol/L e transferiu todo o material para um balão volumétrico de 250 mL, completando seu volume com água bidestilada. O estudante, em seguida, transferiu 10 mL da solução obtida para um balão volumétrico de 100 mL que também teve seu volume completado com água bidestilada. O estudante de Química levou essa última solução a um fotômetro de chama e percebeu que essa solução emitia a luz característica do lítio com uma intensidade igual a 19,8. O estudante também mediu a intensidade de luz emitida por uma série de soluções padrões de lítio e, por meio de uma regressão linear, obteve a seguinte curva de calibração: I = 0,11C 1,86; onde C é a concentração de Li+ em mg/L.
Assinale a opção que mostra a massa de lítio, em miligramas, em um comprimido do antidepressivo.
182,6 mg
198,1 mg
454,0 mg
492,3 mg
721,4 mg
Você está em uma indústria química e para continuar o processo de produção de um produto é necessário medir o volume exato de um reator para que se possam colocar as quantidades corretas de determinados reagentes. No entanto, o reator possui uma forma irregular, não podendo ser usados recursos matemáticos para encontrar tal volume. Você, um pouco desesperado, começa a recordar das aulas de Química e idealiza o seguinte experimento:
Preparou-se uma solução de Zn2+ na concentração de 12,5 g/L e, a seguir, transferiu-se 100 mL da solução para o reator. Em seguida, completou-se o reator com água pura (livre de impurezas, tais como íons) homogeneizando a solução. Essa solução foi levada até um aparelho de absorção atômica, apresentando uma absorbância de 0,498.
Uma curva analítica de calibração foi obtida a partir de soluções padrão de Zn2+ e a equação encontrada está apresentada, a seguir: Abs = 0,9971.CZn2+ - 0,0007 onde CZn2+ está em mg/L. A partir das informações anteriores, determine o volume, em L, do reator.
250 L
1000 L
2500 L
1500 L
100 L
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
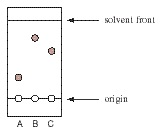 Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.
Numa determinação de Pb2+ no sangue de um paciente uma solução padrão de Pb2+apresentou absorbância igual 0,400. Quando se leu a solução amostra, foi encontrado um valor de absorbância igual a 0,100. Com isso o analista conclui que a concentração da solução amostra era de 5 mg/L de Pb2+. Sendo assim, qual a concentração da solução padrão usada pelo analista?
201 M-1.cm-1 e 5,43mg/L
201 M-1.cm-1 e 27,1 mg/L
2,58 M-1.cm-1 e 27,1 mg/L
201 M-1.cm-1 e 0,0695 mg/L
2,58 M-1.cm-1 e 5,43 mg/L
Uma solução de um dado composto apresenta uma absortividade molar de 8,5x103 M-1 cm-1 em 450 nm. Qual será a absorbância de uma solução do mesmo composto na concentração de 1,2x10-5 mol/L quando medido em 450 nm em cubetas de 5,00 cm?
0,510
0,876
2,457
0,367
0,456
O manitol é um diurético e agente de diagnóstico para avaliação da função renal. Um lote de manitol está sob suspeita de estar contaminado por chumbo (Pb2+). Em uma análise foram pesados 200 mg de manitol sendo cuidadosamente transferido para um balão volumétrico de 250,0 mL. A medida dessa solução em um aparelho de absorção atômica equipado com lâmpada de chumbo, apresentou uma absorbância de 0,140. A medida de alguns padrões permitiu-se obter a seguinte curva de calibração:
Abs = 0,0178 CPb2+ - 0,0022 , onde CPb2+ está em mg/L.
Sobre a questão acima, pergunta-se: Calcule a concentração de Pb2+, em mg/L, na solução amostra de manitol.
4,875
7,988
7,742
2,963
5,455
A figura abaixo representa um cromatograma em que se realizou a separação de várias substâncias em fase estacionária apolar. Analisando o cromatograma, estrutura dos compostos e sabendo que a ordem de eluição é a ordem numérica dos compostos, assinale a alternativa que explica por que a substância 3 elui primeiro que a substância 4, mesmo sabendo que a substância 3 possua um grupo metil a mais que a substância 4.

O composto 4 apresenta 1 hidroxila a mais que o composto 3.
O composto 2 tem polaridade igual ao composto 3, portanto repele esse composto, fazendo-o se aproximar do composto 4.
O composto 3 apresenta viscosidade maior que o composto 4, por isso percorre o leito mais rápido que o composto 4.
O composto 3 é ligeiramente mais polar que o composto 4, porque apresenta mais ligações duplas.
Os dois compostos são lipídeos com pontos de ebulição muito próximos.
A dipirona (sal de sódio do 1-fenil2,3dimetil-4-metilaminometanossulfonato5pirazolona) é um pó cristalino branco, solúvel em água e álcool, que apresenta atividades analgésicas e antipiréticas. Recentemente foi desenvolvida uma técnica para determinação de dipirona sódica em várias formulações farmacêuticas. A dipirona sódica quando em contato com íons prata (Ag+) são reduzidos a uma suspensão coloidal (suspensão de partículas) de prata metálica (Ag0), que é liberada pela reação e monitorada em 425 nm. A reação citada é apresentada a seguir:

O método empregado para determinação de dipirona sódica em solução de Novalgina® foi de acordo com o procedimento a seguir: Transferiu-se 2,0 mL de Novalgina®para um balão volumétrico de 500 mL. Em seguida, 10,0 mL da última foram transferidos para um balão volumétrico de 100 mL, ao qual foi adicionado uma quantidade conveniente de íons Ag+, tendo seu volume completado até a marca. Posteriormente, efetuou-se a medida de absorbância dessa solução, encontrando uma absorbância de 0,048.
Abs = 0,228.C + 9,81x10-4 (g/L) r2 = 0,9996
A partir da curva analítica de calibração e informações anteriores, determine a concentração, de dipirona sódica, em mg/mL, na Novalgina.
515
1000
450
310
188
No curso de Química, um estudante realizou um experimento em que ele triturou um comprimido antidepressivo em um almofariz, em seguida, ele dissolveu a amostra do comprimido em solução de ácido clorídrico 0,1 mol/L e transferiu todo o material para um balão volumétrico de 250 mL, completando seu volume com água bidestilada. O estudante, em seguida, transferiu 10 mL da solução obtida para um balão volumétrico de 100 mL que também teve seu volume completado com água bidestilada. O estudante de Química levou essa última solução a um fotômetro de chama e percebeu que essa solução emitia a luz característica do lítio com uma intensidade igual a 19,8. O estudante também mediu a intensidade de luz emitida por uma série de soluções padrões de lítio e, por meio de uma regressão linear, obteve a seguinte curva de calibração: I = 0,11C 1,86; onde C é a concentração de Li+ em mg/L.
Assinale a opção que mostra a massa de lítio, em miligramas, em um comprimido do antidepressivo.
182,6 mg
198,1 mg
454,0 mg
492,3 mg
721,4 mg
Você está em uma indústria química e para continuar o processo de produção de um produto é necessário medir o volume exato de um reator para que se possam colocar as quantidades corretas de determinados reagentes. No entanto, o reator possui uma forma irregular, não podendo ser usados recursos matemáticos para encontrar tal volume. Você, um pouco desesperado, começa a recordar das aulas de Química e idealiza o seguinte experimento:
Preparou-se uma solução de Zn2+ na concentração de 12,5 g/L e, a seguir, transferiu-se 100 mL da solução para o reator. Em seguida, completou-se o reator com água pura (livre de impurezas, tais como íons) homogeneizando a solução. Essa solução foi levada até um aparelho de absorção atômica, apresentando uma absorbância de 0,498.
Uma curva analítica de calibração foi obtida a partir de soluções padrão de Zn2+ e a equação encontrada está apresentada, a seguir: Abs = 0,9971.CZn2+ - 0,0007 onde CZn2+ está em mg/L. A partir das informações anteriores, determine o volume, em L, do reator.
250 L
1000 L
2500 L
1500 L
100 L
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
 Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.
Numa determinação de Pb2+ no sangue de um paciente uma solução padrão de Pb2+apresentou absorbância igual 0,400. Quando se leu a solução amostra, foi encontrado um valor de absorbância igual a 0,100. Com isso o analista conclui que a concentração da solução amostra era de 5 mg/L de Pb2+. Sendo assim, qual a concentração da solução padrão usada pelo analista?
0,510
0,876
2,457
0,367
0,456
O manitol é um diurético e agente de diagnóstico para avaliação da função renal. Um lote de manitol está sob suspeita de estar contaminado por chumbo (Pb2+). Em uma análise foram pesados 200 mg de manitol sendo cuidadosamente transferido para um balão volumétrico de 250,0 mL. A medida dessa solução em um aparelho de absorção atômica equipado com lâmpada de chumbo, apresentou uma absorbância de 0,140. A medida de alguns padrões permitiu-se obter a seguinte curva de calibração:
Abs = 0,0178 CPb2+ - 0,0022 , onde CPb2+ está em mg/L.
Sobre a questão acima, pergunta-se: Calcule a concentração de Pb2+, em mg/L, na solução amostra de manitol.
4,875
7,988
7,742
2,963
5,455
A figura abaixo representa um cromatograma em que se realizou a separação de várias substâncias em fase estacionária apolar. Analisando o cromatograma, estrutura dos compostos e sabendo que a ordem de eluição é a ordem numérica dos compostos, assinale a alternativa que explica por que a substância 3 elui primeiro que a substância 4, mesmo sabendo que a substância 3 possua um grupo metil a mais que a substância 4.

O composto 4 apresenta 1 hidroxila a mais que o composto 3.
O composto 2 tem polaridade igual ao composto 3, portanto repele esse composto, fazendo-o se aproximar do composto 4.
O composto 3 apresenta viscosidade maior que o composto 4, por isso percorre o leito mais rápido que o composto 4.
O composto 3 é ligeiramente mais polar que o composto 4, porque apresenta mais ligações duplas.
Os dois compostos são lipídeos com pontos de ebulição muito próximos.
A dipirona (sal de sódio do 1-fenil2,3dimetil-4-metilaminometanossulfonato5pirazolona) é um pó cristalino branco, solúvel em água e álcool, que apresenta atividades analgésicas e antipiréticas. Recentemente foi desenvolvida uma técnica para determinação de dipirona sódica em várias formulações farmacêuticas. A dipirona sódica quando em contato com íons prata (Ag+) são reduzidos a uma suspensão coloidal (suspensão de partículas) de prata metálica (Ag0), que é liberada pela reação e monitorada em 425 nm. A reação citada é apresentada a seguir:

O método empregado para determinação de dipirona sódica em solução de Novalgina® foi de acordo com o procedimento a seguir: Transferiu-se 2,0 mL de Novalgina®para um balão volumétrico de 500 mL. Em seguida, 10,0 mL da última foram transferidos para um balão volumétrico de 100 mL, ao qual foi adicionado uma quantidade conveniente de íons Ag+, tendo seu volume completado até a marca. Posteriormente, efetuou-se a medida de absorbância dessa solução, encontrando uma absorbância de 0,048.
Abs = 0,228.C + 9,81x10-4 (g/L) r2 = 0,9996
A partir da curva analítica de calibração e informações anteriores, determine a concentração, de dipirona sódica, em mg/mL, na Novalgina.
515
1000
450
310
188
No curso de Química, um estudante realizou um experimento em que ele triturou um comprimido antidepressivo em um almofariz, em seguida, ele dissolveu a amostra do comprimido em solução de ácido clorídrico 0,1 mol/L e transferiu todo o material para um balão volumétrico de 250 mL, completando seu volume com água bidestilada. O estudante, em seguida, transferiu 10 mL da solução obtida para um balão volumétrico de 100 mL que também teve seu volume completado com água bidestilada. O estudante de Química levou essa última solução a um fotômetro de chama e percebeu que essa solução emitia a luz característica do lítio com uma intensidade igual a 19,8. O estudante também mediu a intensidade de luz emitida por uma série de soluções padrões de lítio e, por meio de uma regressão linear, obteve a seguinte curva de calibração: I = 0,11C 1,86; onde C é a concentração de Li+ em mg/L.
Assinale a opção que mostra a massa de lítio, em miligramas, em um comprimido do antidepressivo.
182,6 mg
198,1 mg
454,0 mg
492,3 mg
721,4 mg
Você está em uma indústria química e para continuar o processo de produção de um produto é necessário medir o volume exato de um reator para que se possam colocar as quantidades corretas de determinados reagentes. No entanto, o reator possui uma forma irregular, não podendo ser usados recursos matemáticos para encontrar tal volume. Você, um pouco desesperado, começa a recordar das aulas de Química e idealiza o seguinte experimento:
Preparou-se uma solução de Zn2+ na concentração de 12,5 g/L e, a seguir, transferiu-se 100 mL da solução para o reator. Em seguida, completou-se o reator com água pura (livre de impurezas, tais como íons) homogeneizando a solução. Essa solução foi levada até um aparelho de absorção atômica, apresentando uma absorbância de 0,498.
Uma curva analítica de calibração foi obtida a partir de soluções padrão de Zn2+ e a equação encontrada está apresentada, a seguir: Abs = 0,9971.CZn2+ - 0,0007 onde CZn2+ está em mg/L. A partir das informações anteriores, determine o volume, em L, do reator.
250 L
1000 L
2500 L
1500 L
100 L
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
 Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.
Numa determinação de Pb2+ no sangue de um paciente uma solução padrão de Pb2+apresentou absorbância igual 0,400. Quando se leu a solução amostra, foi encontrado um valor de absorbância igual a 0,100. Com isso o analista conclui que a concentração da solução amostra era de 5 mg/L de Pb2+. Sendo assim, qual a concentração da solução padrão usada pelo analista?
4,875
7,988
7,742
2,963
5,455
A figura abaixo representa um cromatograma em que se realizou a separação de várias substâncias em fase estacionária apolar. Analisando o cromatograma, estrutura dos compostos e sabendo que a ordem de eluição é a ordem numérica dos compostos, assinale a alternativa que explica por que a substância 3 elui primeiro que a substância 4, mesmo sabendo que a substância 3 possua um grupo metil a mais que a substância 4.

O composto 4 apresenta 1 hidroxila a mais que o composto 3.
O composto 2 tem polaridade igual ao composto 3, portanto repele esse composto, fazendo-o se aproximar do composto 4.
O composto 3 apresenta viscosidade maior que o composto 4, por isso percorre o leito mais rápido que o composto 4.
O composto 3 é ligeiramente mais polar que o composto 4, porque apresenta mais ligações duplas.
Os dois compostos são lipídeos com pontos de ebulição muito próximos.
A dipirona (sal de sódio do 1-fenil2,3dimetil-4-metilaminometanossulfonato5pirazolona) é um pó cristalino branco, solúvel em água e álcool, que apresenta atividades analgésicas e antipiréticas. Recentemente foi desenvolvida uma técnica para determinação de dipirona sódica em várias formulações farmacêuticas. A dipirona sódica quando em contato com íons prata (Ag+) são reduzidos a uma suspensão coloidal (suspensão de partículas) de prata metálica (Ag0), que é liberada pela reação e monitorada em 425 nm. A reação citada é apresentada a seguir:

O método empregado para determinação de dipirona sódica em solução de Novalgina® foi de acordo com o procedimento a seguir: Transferiu-se 2,0 mL de Novalgina®para um balão volumétrico de 500 mL. Em seguida, 10,0 mL da última foram transferidos para um balão volumétrico de 100 mL, ao qual foi adicionado uma quantidade conveniente de íons Ag+, tendo seu volume completado até a marca. Posteriormente, efetuou-se a medida de absorbância dessa solução, encontrando uma absorbância de 0,048.
Abs = 0,228.C + 9,81x10-4 (g/L) r2 = 0,9996
A partir da curva analítica de calibração e informações anteriores, determine a concentração, de dipirona sódica, em mg/mL, na Novalgina.
515
1000
450
310
188
No curso de Química, um estudante realizou um experimento em que ele triturou um comprimido antidepressivo em um almofariz, em seguida, ele dissolveu a amostra do comprimido em solução de ácido clorídrico 0,1 mol/L e transferiu todo o material para um balão volumétrico de 250 mL, completando seu volume com água bidestilada. O estudante, em seguida, transferiu 10 mL da solução obtida para um balão volumétrico de 100 mL que também teve seu volume completado com água bidestilada. O estudante de Química levou essa última solução a um fotômetro de chama e percebeu que essa solução emitia a luz característica do lítio com uma intensidade igual a 19,8. O estudante também mediu a intensidade de luz emitida por uma série de soluções padrões de lítio e, por meio de uma regressão linear, obteve a seguinte curva de calibração: I = 0,11C 1,86; onde C é a concentração de Li+ em mg/L.
Assinale a opção que mostra a massa de lítio, em miligramas, em um comprimido do antidepressivo.
182,6 mg
198,1 mg
454,0 mg
492,3 mg
721,4 mg
Você está em uma indústria química e para continuar o processo de produção de um produto é necessário medir o volume exato de um reator para que se possam colocar as quantidades corretas de determinados reagentes. No entanto, o reator possui uma forma irregular, não podendo ser usados recursos matemáticos para encontrar tal volume. Você, um pouco desesperado, começa a recordar das aulas de Química e idealiza o seguinte experimento:
Preparou-se uma solução de Zn2+ na concentração de 12,5 g/L e, a seguir, transferiu-se 100 mL da solução para o reator. Em seguida, completou-se o reator com água pura (livre de impurezas, tais como íons) homogeneizando a solução. Essa solução foi levada até um aparelho de absorção atômica, apresentando uma absorbância de 0,498.
Uma curva analítica de calibração foi obtida a partir de soluções padrão de Zn2+ e a equação encontrada está apresentada, a seguir: Abs = 0,9971.CZn2+ - 0,0007 onde CZn2+ está em mg/L. A partir das informações anteriores, determine o volume, em L, do reator.
250 L
1000 L
2500 L
1500 L
100 L
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
 Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.
Numa determinação de Pb2+ no sangue de um paciente uma solução padrão de Pb2+apresentou absorbância igual 0,400. Quando se leu a solução amostra, foi encontrado um valor de absorbância igual a 0,100. Com isso o analista conclui que a concentração da solução amostra era de 5 mg/L de Pb2+. Sendo assim, qual a concentração da solução padrão usada pelo analista?

O composto 4 apresenta 1 hidroxila a mais que o composto 3.
O composto 2 tem polaridade igual ao composto 3, portanto repele esse composto, fazendo-o se aproximar do composto 4.
O composto 3 apresenta viscosidade maior que o composto 4, por isso percorre o leito mais rápido que o composto 4.
O composto 3 é ligeiramente mais polar que o composto 4, porque apresenta mais ligações duplas.
Os dois compostos são lipídeos com pontos de ebulição muito próximos.
A dipirona (sal de sódio do 1-fenil2,3dimetil-4-metilaminometanossulfonato5pirazolona) é um pó cristalino branco, solúvel em água e álcool, que apresenta atividades analgésicas e antipiréticas. Recentemente foi desenvolvida uma técnica para determinação de dipirona sódica em várias formulações farmacêuticas. A dipirona sódica quando em contato com íons prata (Ag+) são reduzidos a uma suspensão coloidal (suspensão de partículas) de prata metálica (Ag0), que é liberada pela reação e monitorada em 425 nm. A reação citada é apresentada a seguir:

O método empregado para determinação de dipirona sódica em solução de Novalgina® foi de acordo com o procedimento a seguir: Transferiu-se 2,0 mL de Novalgina®para um balão volumétrico de 500 mL. Em seguida, 10,0 mL da última foram transferidos para um balão volumétrico de 100 mL, ao qual foi adicionado uma quantidade conveniente de íons Ag+, tendo seu volume completado até a marca. Posteriormente, efetuou-se a medida de absorbância dessa solução, encontrando uma absorbância de 0,048.
Abs = 0,228.C + 9,81x10-4 (g/L) r2 = 0,9996
A partir da curva analítica de calibração e informações anteriores, determine a concentração, de dipirona sódica, em mg/mL, na Novalgina.
515
1000
450
310
188
No curso de Química, um estudante realizou um experimento em que ele triturou um comprimido antidepressivo em um almofariz, em seguida, ele dissolveu a amostra do comprimido em solução de ácido clorídrico 0,1 mol/L e transferiu todo o material para um balão volumétrico de 250 mL, completando seu volume com água bidestilada. O estudante, em seguida, transferiu 10 mL da solução obtida para um balão volumétrico de 100 mL que também teve seu volume completado com água bidestilada. O estudante de Química levou essa última solução a um fotômetro de chama e percebeu que essa solução emitia a luz característica do lítio com uma intensidade igual a 19,8. O estudante também mediu a intensidade de luz emitida por uma série de soluções padrões de lítio e, por meio de uma regressão linear, obteve a seguinte curva de calibração: I = 0,11C 1,86; onde C é a concentração de Li+ em mg/L.
Assinale a opção que mostra a massa de lítio, em miligramas, em um comprimido do antidepressivo.
182,6 mg
198,1 mg
454,0 mg
492,3 mg
721,4 mg
Você está em uma indústria química e para continuar o processo de produção de um produto é necessário medir o volume exato de um reator para que se possam colocar as quantidades corretas de determinados reagentes. No entanto, o reator possui uma forma irregular, não podendo ser usados recursos matemáticos para encontrar tal volume. Você, um pouco desesperado, começa a recordar das aulas de Química e idealiza o seguinte experimento:
Preparou-se uma solução de Zn2+ na concentração de 12,5 g/L e, a seguir, transferiu-se 100 mL da solução para o reator. Em seguida, completou-se o reator com água pura (livre de impurezas, tais como íons) homogeneizando a solução. Essa solução foi levada até um aparelho de absorção atômica, apresentando uma absorbância de 0,498.
Uma curva analítica de calibração foi obtida a partir de soluções padrão de Zn2+ e a equação encontrada está apresentada, a seguir: Abs = 0,9971.CZn2+ - 0,0007 onde CZn2+ está em mg/L. A partir das informações anteriores, determine o volume, em L, do reator.
250 L
1000 L
2500 L
1500 L
100 L
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
 Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.
Numa determinação de Pb2+ no sangue de um paciente uma solução padrão de Pb2+apresentou absorbância igual 0,400. Quando se leu a solução amostra, foi encontrado um valor de absorbância igual a 0,100. Com isso o analista conclui que a concentração da solução amostra era de 5 mg/L de Pb2+. Sendo assim, qual a concentração da solução padrão usada pelo analista?
515
1000
450
310
188
No curso de Química, um estudante realizou um experimento em que ele triturou um comprimido antidepressivo em um almofariz, em seguida, ele dissolveu a amostra do comprimido em solução de ácido clorídrico 0,1 mol/L e transferiu todo o material para um balão volumétrico de 250 mL, completando seu volume com água bidestilada. O estudante, em seguida, transferiu 10 mL da solução obtida para um balão volumétrico de 100 mL que também teve seu volume completado com água bidestilada. O estudante de Química levou essa última solução a um fotômetro de chama e percebeu que essa solução emitia a luz característica do lítio com uma intensidade igual a 19,8. O estudante também mediu a intensidade de luz emitida por uma série de soluções padrões de lítio e, por meio de uma regressão linear, obteve a seguinte curva de calibração: I = 0,11C 1,86; onde C é a concentração de Li+ em mg/L.
Assinale a opção que mostra a massa de lítio, em miligramas, em um comprimido do antidepressivo.
182,6 mg
198,1 mg
454,0 mg
492,3 mg
721,4 mg
Você está em uma indústria química e para continuar o processo de produção de um produto é necessário medir o volume exato de um reator para que se possam colocar as quantidades corretas de determinados reagentes. No entanto, o reator possui uma forma irregular, não podendo ser usados recursos matemáticos para encontrar tal volume. Você, um pouco desesperado, começa a recordar das aulas de Química e idealiza o seguinte experimento:
Preparou-se uma solução de Zn2+ na concentração de 12,5 g/L e, a seguir, transferiu-se 100 mL da solução para o reator. Em seguida, completou-se o reator com água pura (livre de impurezas, tais como íons) homogeneizando a solução. Essa solução foi levada até um aparelho de absorção atômica, apresentando uma absorbância de 0,498.
Uma curva analítica de calibração foi obtida a partir de soluções padrão de Zn2+ e a equação encontrada está apresentada, a seguir: Abs = 0,9971.CZn2+ - 0,0007 onde CZn2+ está em mg/L. A partir das informações anteriores, determine o volume, em L, do reator.
250 L
1000 L
2500 L
1500 L
100 L
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
 Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.
Numa determinação de Pb2+ no sangue de um paciente uma solução padrão de Pb2+apresentou absorbância igual 0,400. Quando se leu a solução amostra, foi encontrado um valor de absorbância igual a 0,100. Com isso o analista conclui que a concentração da solução amostra era de 5 mg/L de Pb2+. Sendo assim, qual a concentração da solução padrão usada pelo analista?
182,6 mg
198,1 mg
454,0 mg
492,3 mg
721,4 mg
Você está em uma indústria química e para continuar o processo de produção de um produto é necessário medir o volume exato de um reator para que se possam colocar as quantidades corretas de determinados reagentes. No entanto, o reator possui uma forma irregular, não podendo ser usados recursos matemáticos para encontrar tal volume. Você, um pouco desesperado, começa a recordar das aulas de Química e idealiza o seguinte experimento:
Preparou-se uma solução de Zn2+ na concentração de 12,5 g/L e, a seguir, transferiu-se 100 mL da solução para o reator. Em seguida, completou-se o reator com água pura (livre de impurezas, tais como íons) homogeneizando a solução. Essa solução foi levada até um aparelho de absorção atômica, apresentando uma absorbância de 0,498.
Uma curva analítica de calibração foi obtida a partir de soluções padrão de Zn2+ e a equação encontrada está apresentada, a seguir: Abs = 0,9971.CZn2+ - 0,0007 onde CZn2+ está em mg/L. A partir das informações anteriores, determine o volume, em L, do reator.
250 L
1000 L
2500 L
1500 L
100 L
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
 Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.
Numa determinação de Pb2+ no sangue de um paciente uma solução padrão de Pb2+apresentou absorbância igual 0,400. Quando se leu a solução amostra, foi encontrado um valor de absorbância igual a 0,100. Com isso o analista conclui que a concentração da solução amostra era de 5 mg/L de Pb2+. Sendo assim, qual a concentração da solução padrão usada pelo analista?
250 L
1000 L
2500 L
1500 L
100 L
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
 Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.
Numa determinação de Pb2+ no sangue de um paciente uma solução padrão de Pb2+apresentou absorbância igual 0,400. Quando se leu a solução amostra, foi encontrado um valor de absorbância igual a 0,100. Com isso o analista conclui que a concentração da solução amostra era de 5 mg/L de Pb2+. Sendo assim, qual a concentração da solução padrão usada pelo analista?
O composto A e B possui o mesmo valor de Rf.
O composto B possui menor Rf e eluirá primeiro.
O composto A possui maior Rf e eluirá primeiro.
O composto B possui maior Rf e eluirá primeiro.
O composto C possui menor Rf e eluirá primeiro.